Công nghệ sản xuất Amoniac, Acid Nitric và Phân Đạm
I. Amoniac
Trên thế giới có rất nhiều nhà máy sản xuất amoniac với quy mô lớn với sản lượng từ 2000 - 3000 tấn/ngày .Sản lượng amôniac sản xuất mỗi năm mỗi tăng: năm 2004 là 109.000.000 tấn, năm 2006 là 122.000.000 tấn
Dẫn đầu là Trung Quốc với 28,4% tổng sản lượng trên toàn thế giới, theo sau là Ấn Độ với 8,6%, Nga với 8,4%, và Hoa kỳ là 8,2%.
Vì sao phải sản xuất amôniac với số lượng lớn?
- Trước đây: Dùng phương pháp Rothe- Frank- Caro
CaCN2 + 3H2O = CaCO3 + 2NH3
- Ngày nay: dùng phương pháp Haber Process
+ Nguồn nguyên liệu: O2, N2, H2, khí tự nhiên CH4 hoặc khí đốt hóa lỏng như propan và butan, …
Vì nguyên liệu có lẫn tạp chất lưu huỳnh hữu cơ (RSH) nên ta sẽ có công đoạn khử S trước khi đưa nguyên liệu vào quy trinh sản xuất.
+ Trong quá trình khử này các tạp chất lưu huỳnh hữu cơ được chuyển hoá thành H2S bằng xúc tác hydro hoá. Sau đó H2S được hấp phụ bằng oxit kẽm.
RSH + H2 = RH + H2S
ZnO + H2S = ZnS + H2O

Công đoạn khử CO2
-
Khử CO2
Hệ thống tách CO2 được dựa trên quá trình MDEA (methyldietanolamin) bao gồm một tháp hấp thụ CO2 hai cấp, một tháp chưng cất CO2 và hai bình tách.
CO2 bị tách khỏi quá trình bởi sự hấp thụ CO2 vào trong dung dịch MDEA chứa 40% MDEA.
R3N + H2O + CO2 = R3NH+ + HCO3-
2R2NH + CO2 = R2NH2+ + R2N- COO-
-
Thu hồi CO2
Tách tái sinh dung dịch giàu CO2 được thực hiện trong hai cấp để được CO2 độ tinh khiết cao. Trong bình tách cao áp, hầu hết các thành phần trơ được hoà tan và giải phóng tại áp suất khoảng 5,5 bar.
Dung dịch giàu CO2 tiếp tục đến bình tách thấp áp và được giải phóng khỏi dung dịch tại áp suất 0,27 bar.
Công đoạn mêtan hóa
CO và CO2 dư được chuyển hoá thành metan bởi phản ứng với hydro (metan hoá) trước khi khí tổng hợp được đưa đến vòng tổng hợp amôniắc.
CO + 3H2 = CH4 + H2O + Q
CO2 + 4H2 = CH4 + 2H2O + Q
Metan là khí trơ trong vòng tổng hợp amôniắc, các hợp chất chứa oxy như là CO và CO2 sẽ phản ứng với chất xúc tác trong vòng tổng hợp amôniắc.
Vòng tổng hợp Amôniắc
Khí công nghệ sau khi mêtan hóa được nén lên áp suất cao và sau đó dẫn vào cụm tổng hợp amôniắc.
P/ư tổng hợp Amôniắc:
N2 + 3H2 <=> 2NH3 + Q (Điều kiện: Fe, 400o- 500oC, 200 atm)

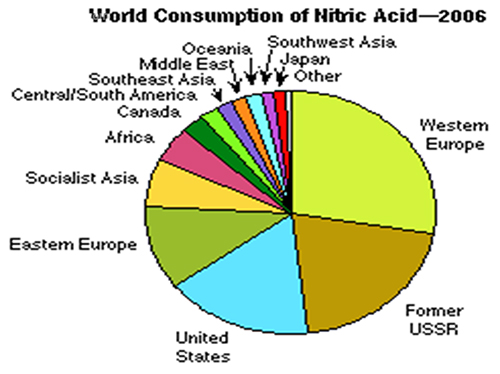
Vì sao phải sản xuất và tiêu thụ Acid Nitric với số lượng lớn như vậy?

Vì ngoài sử dụng HNO3 làm phân bón, HNO3 còn còn dùng để: Làm thuốc nổ TNT, thuốc nhuộm, dược phẩm...
Axit nitric cũng là một thành phần của giải pháp Nital, đó là một giải pháp thử nghiệm kim loại
Quy trình sản xuất Acid Nitric
-
Các phương pháp sản xuất HNO3
- Đầu thế kỷ 17: H2SO4 đđ + KNO3 (diêm tiêu) = KHSO4 + HNO3
về sau nguồn nguyên liệu quặng nitơrat trong thiên nhiên không phổ biến.
- Đầu TK 20: dùng phương pháp hồ quang điện (N2 + O2 KK ở nhiệt độ cao).
N2 + O2 = 2NO
2NO + O2 = 2NO2
3NO2 + H2O = 2HNO3 + NO
Phương pháp này tốn nhiều điện năng à từ khi tổng hợp được NH3 dùng: PP oxi hoá NH3 (3gđ)
- Giai đoạn 1: Oxi hoá NH3 thành NO (PP tiếp xúc)
Tuỳ điều kiện và chất phản ứng mà xảy ra theo các phản ứng
4NH3 + 5O2 - > 4NO + 6H2O (1)
4NH3 + 4O2 - > 4N2O + 6H2O (2)
4NH3 + 3O2 - > 2N2O + 6H2O (3)
(1) (2) (3): một chiều, đồng thể, toả nhiệt -> TPSP phụ thuộc vào tốc độ các phản ứng. Vậy để sản xuất HNO3 người ta tìm cách để phản ứng (1) xảy ra với tốc độ nhanh nhất và hạn chế phản ứng (2) (3) với tốc độ nhỏ nhất
- Giai đoạn 2: oxi hoá NO thành NO2
2NO + O2 <=> 2NO2
Nhiệt độ < 1500oC phản ứng xảy ra hoàn toàn theo chiều thuận (1 chiều)
Nhiệt độ > 1500oC phản ứng thuận nghịch, nhiệt độ > 8000oC sự oxi hoá không xảy ra
Nếu trong điều kiện không đủ O2 -> hh khí ngoài NO2 còn có N2O3, N2O4, NO
(N2O4 tạo thành ở nhiệt độ thấp dư O2, 2NO + O2 -> N2O4)
Thực nghiệm cho thấy để đạt hiệu suất NO2, N2O4 cao thì P = 8 - 10atm, to < 2000oC.
- Giai đoạn 3: hấp thụ NO2 bằng H2O
Phản ứng 2NO2 + H2O - > HNO3 + HNO2
(NO không tan trong nước) N2O4 + H2O - > HNO3 + HNO2
N2O3 + H2O - > 2HNO2
HNO2 không bền, phân hủy: 3HNO2 - > HNO3 + 2NO + H2O
- > Phản ứng tổng quát: 3NO2 + H2O = 2HNO3 + NO
Vì quá trình toả nhiệt -> hạ thấp nhiệt độ tăng áp suất (p) làm sạch chất lỏng trong tháp hấp thụ đến nhiệt độ 750oC.
ở 250oC P = 1atm dung dịch HNO3 : 48 - 50%
P = 8- 10atm đHNO3 > 60 - 62%
quá trình xảy ra đồng thời với giai đoạn 2
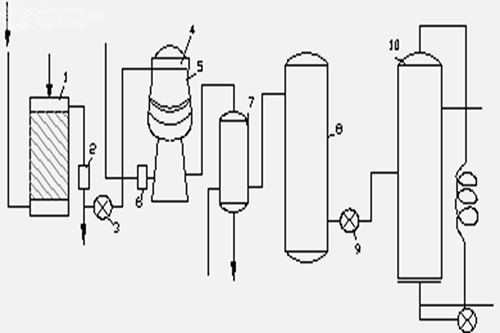
(1): Thiết bị làm sạch kk (H2O hoặc Na2CO3)
(2): Thiết bị lọc các tạp chất cơ học
(3), (9): Quạt
(4): Thiết bị lọc cactong cùng với khí NH3
(5): Thiết bị oxi hóa NH3
(6): Thiết bị thu hồi
(7),(8): Tháp làm lạnh
(10): Tháp hấp thụ
III. Phân đạm
Phân đạm là tên gọi chung của các loại phân bón vô cơ cung cấp đạm cho cây dưới dạng NO3- ,NH4+.Phân đạm kích thích quá trình sinh trưởng, làm tăng tỉ lệ protein thực vật nên phân đạm là chất dinh dưỡng rất cần thiết và rất quan trọng đối với cây - thành phần chính của clorophin, prôtit, các axit amin, các enzym và nhiều loại vitamin trong cây.
Có 3 nhóm đạm chính
- Nhóm đạm amoni: (NH4)2SO4,NH4Cl, …
- Nhóm đạm Nitrat: NaNO3,KNO3, NH4NO3, …
- Nhóm đạm amit: CaCN2, CO(NH2)2.
1. Nhóm đạm amit
-
Phân Urê CO(NH2)2:
Phân urê có 44 - 48% N, chiếm khoảng 59% các loại phân đạm được sản xuất ở các nước trên thế giới. Có 2 loại phân urê:
- Loại tinh thể màu trắng, hạt tròn, dễ tan trong nước, có nhược điểm là hút ẩm mạnh.
- Loại có dạng viên nhỏ, có thêm chất chống ẩm nên dễ bảo quản,dễ vận chuyển được dùng nhiều trong sản xuất nông nghiệp.
Phân Urê bón thích hợp trên đất chua phèn, được dùng để bón thúc.
2. Nhóm đạm Nitrát
-
Phân đạm Clorua (NH4Cl):
- Phân này có chứa 24 - 25% N. NH4Cl có dạng tinh thể mịn, màu trắng hoặc vàng ngà.
- Phân này dễ tan trong nước, ít hút ẩm, không bị vón cục, thường tơi rời nên dễ sử dụng.
- Là loại phân sinh lý chua. Vì vậy, nên bón kết hợp với lân và các loại phân bón khác.
- NH4Cl không nên dùng để bón cho thuốc lá, chè, khoai tây, hành, tỏi, bắp cải, vừng, v.v... Ở các vùng khô hạn, ở các chân đất nhiễm mặn không nên bón phân đạm clorua, vì ở những nơi này trong đất có thể tích luỹ nhiều clo, dễ làm cho cây bị ngộ độc.
Điều chế phân đạm Nitorat
Phương pháp amoniac hóa: (Điều chế từ nước lọc của quá trình sản xuất Na2CO3).
NaCl + NH3 + H2O + CO2 = NH4Cl + NaHCO3 (1)
(cho dung dịch NaCl bão hòa vào dung dịch NH3 20% sau đó dẫn khí CO2 vào dung dịch kk -> NaHCO3 ít tan, lọc tách )
NaHCO3 = Na2CO3 + H2O + CO2
CO2 tạo thành quay lại phản ứng (1), dung dịch sau (1) là nước ót: NH4Cl, NH4HCO3, (NH4)2CO3, NaCl
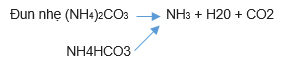
Quay lại phản ứng (1)
Phương pháp trung hòa:
NH3 + HCl = NH4Cl
-
Phân sunphat đạm (NH4)2SO4 (còn gọi là phân SA)
(NH4)2SO4 có chứa: 20 - 21% N, 29% S.
- Dạng tinh thể, mịn, màu trắng ngà hoặc xám xanh, có mùi nước tiểu (mùi NH3), vị mặn và hơi chua, dễ tan trong nước, thường ở trạng thái tơi rời nên dễ bảo quản, dễ sử dụng.
- (NH4)2SO4 là loại phân bón tốt vì có cả N và S là hai chất dinh dưỡng thiết yếu cho cây.
-
Cẩm nang phân đạm: Phần 1: Giới thiệu các loại phân đạm
 Phân đạm là từ chung, dùng để chỉ các loại phân có chứa nitơ. Nhiều người muốn thay chữ phân đạm bằng phân Nitơ, nhưng chúng tôi thiết nghĩ...
Phân đạm là từ chung, dùng để chỉ các loại phân có chứa nitơ. Nhiều người muốn thay chữ phân đạm bằng phân Nitơ, nhưng chúng tôi thiết nghĩ... -
Quá trình phát triển ngành công nghiệp phân bón (Phần cuối)
 Axit nitơric được sử dụng trong sản xuất ammonia nitơrat, canxi nitơrat và kali nitơrat. Các nitơrat này được sử dụng như là các phân bón trực tiếp được trộn với...
Axit nitơric được sử dụng trong sản xuất ammonia nitơrat, canxi nitơrat và kali nitơrat. Các nitơrat này được sử dụng như là các phân bón trực tiếp được trộn với... -
Công nghệ sản xuất đạm hạt vàng, đạm vi lượng, đạm 46N+, Urea Gold, phân bón vi lượng vàng
 Chuẩn bị thiết bị, nguyên liệu, mô tả quy trình công nghệ, hướng dẫn sử dụng, tác dụng của đạm vi lượng hạt vàng, Urea Gold, đạm 46N+, 46N Plus, đạm vi lượng...
Chuẩn bị thiết bị, nguyên liệu, mô tả quy trình công nghệ, hướng dẫn sử dụng, tác dụng của đạm vi lượng hạt vàng, Urea Gold, đạm 46N+, 46N Plus, đạm vi lượng...
-
 Các cách ủ bã cà phê làm phân bón hữu cơ cho cây trồng tại nhà
Các cách ủ bã cà phê làm phân bón hữu cơ cho cây trồng tại nhà
-
 Công thức ủ rác nhà bếp bằng nấm Trichoderma giúp đất tơi xốp, cây tốt bền lâu
Công thức ủ rác nhà bếp bằng nấm Trichoderma giúp đất tơi xốp, cây tốt bền lâu
-
 Vì sao không nên bón phân chuồng chưa hoai mục cho cây trồng?
Vì sao không nên bón phân chuồng chưa hoai mục cho cây trồng?
-
 Sai lầm khi dùng phân lân khiến cây kém phát triển – Bạn có mắc phải
Sai lầm khi dùng phân lân khiến cây kém phát triển – Bạn có mắc phải
-
 Cách sử dụng phân trùn quế đúng chuẩn để tăng năng suất cây trồng
Cách sử dụng phân trùn quế đúng chuẩn để tăng năng suất cây trồng
-
 Humic và Fulvic – Cặp đôi hoàn hảo cho sức khỏe đất và cây trồng
Humic và Fulvic – Cặp đôi hoàn hảo cho sức khỏe đất và cây trồng
 Danh mục cây trồng
Danh mục cây trồng Côn trùng hại cây trồng
Côn trùng hại cây trồng Bệnh hại cây trồng
Bệnh hại cây trồng Dinh dưỡng cây trồng
Dinh dưỡng cây trồng Bài chuyên mục
Bài chuyên mục Liên hệ
Liên hệ



 Cây mai chiếu thủy
Cây mai chiếu thủy
 Cây đào
Cây đào
 Cây hoa hồng
Cây hoa hồng
 Cây nhãn
Cây nhãn
 COMBO COMBI 05: Biến vàng thành xanh
COMBO COMBI 05: Biến vàng thành xanh
 COMBO T-ROOT kích rễ toàn diện - phục hồi cây yếu, thúc rễ cực mạnh
COMBO T-ROOT kích rễ toàn diện - phục hồi cây yếu, thúc rễ cực mạnh
 Sử dụng kết hợp đạm Ure và Atonik đậm đặc - 'Công thức vàng' trong sử dụng phân bón
Sử dụng kết hợp đạm Ure và Atonik đậm đặc - 'Công thức vàng' trong sử dụng phân bón
 Những tác dụng và tính năng nổi bật khi sử dụng Cytokinin DA6 trên cây trồng
Những tác dụng và tính năng nổi bật khi sử dụng Cytokinin DA6 trên cây trồng
 Làm cách nào để ngăn chặn lộc, đọt non trên cây trồng?
Làm cách nào để ngăn chặn lộc, đọt non trên cây trồng?
 Hướng dẫn kích thích hoa ly nở và kìm hãm hoa cúc nở vào đúng dịp Tết
Hướng dẫn kích thích hoa ly nở và kìm hãm hoa cúc nở vào đúng dịp Tết
 Làm cách nào để cây hoa cúc phát triển nhanh và nở hoa đúng thời điểm?
Làm cách nào để cây hoa cúc phát triển nhanh và nở hoa đúng thời điểm?
 Phân bón lót là gì? phân bón thúc là gì? loại phân bón và lượng bón?
Phân bón lót là gì? phân bón thúc là gì? loại phân bón và lượng bón?
 Hướng dẫn pha chế thuốc BoocDo 1%, 5%
Hướng dẫn pha chế thuốc BoocDo 1%, 5%
 Dinh dưỡng Nitơ ở thực vật
Dinh dưỡng Nitơ ở thực vật
 Tìm hiểu về phân chuồng (phân gia súc)
Tìm hiểu về phân chuồng (phân gia súc)

 Trang chủ
Trang chủ
 Cây trồng phong thủy
Cây trồng phong thủy
 Cây CN dài ngày
Cây CN dài ngày
 Cây CN ngắn ngày
Cây CN ngắn ngày
 Cây lương thực
Cây lương thực
 Cây rau màu
Cây rau màu
 Cây ăn quả (trái)
Cây ăn quả (trái)
 Cây cảnh, hoa cảnh
Cây cảnh, hoa cảnh
 Cây thuốc (dược liệu)
Cây thuốc (dược liệu)
 Cây lâm nghiệp
Cây lâm nghiệp
 Cẩm nang phân bón
Cẩm nang phân bón
 Trồng trọt, chăm sóc
Trồng trọt, chăm sóc
 Khoa học nông nghiệp
Khoa học nông nghiệp
 Sức khỏe và làm đẹp
Sức khỏe và làm đẹp

